再這麼配培養基,你的細菌都被毒死了!
文章目錄
本文“巨集基因組”公眾號原創。
作者:猴頭菇5518
編輯:metagenome
微生物培養基的前世
微生物學家使用瓊脂培養基已有120多年的歷史。在1880年,著名的微生物學家科赫(提出病原微生物科赫氏法則)發明了微生物學領域這一革命性技術: 用固體培養基進行的細菌純培養
隨著測序等技術的發展,人們對微生物多樣性的認識也越來越全面,並發現有很多環境中存在的微生物並不能在固體培養基上生長。長期以來,研究人員一直試圖找出限制微生物生長的因素,希望從環境樣品中儘可能多的分離培養高多樣性以及新微生物物種。目前比較廣泛應用的方法包括:微生物的原位培養,微流控技術,以及配製不同營養成分的培養基
為什麼大多數的微生物如此難培養呢?
- 部分微生物生長緩慢
- 在培養基上不形成克隆
- 它們需要一些未知的養分或者生長因子
- 依賴其它微生物或者宿主細胞共生
- 產生對自身作用的毒素
- 部分微生物是寡營養型別,高營養會致死
- 它們在休眠期
- 它們需要持續供給生長底物
但即使這樣,依靠稀釋塗平板方法獲得微生物類群種類還是比較低,為什麼許多微生物不在瓊脂培養基上生長呢
過氧化氫的產生導致許多微生物不能生長
研究者發現,當過氧化氫酶或丙酮酸鹽新增到培養基中時,從瓊脂平板上分離獲得的微生物多樣性顯著增加,這表明表明自由基的氧化作用能抑制特定類群的微生物的生長。
日本科學家Kamagata發現,我們所有人在配製瓊脂培養基過程中都忽略了一個隱藏的陷阱:那就是當磷酸鹽與瓊脂放在一起進行高壓蒸汽滅菌時會產生產生大量的H2O2,而這些H2O2對很多類群的微生物具有強烈的毒害作用。所以與磷酸鹽混合滅菌的瓊脂培養基得到的微生物菌落總數總是顯著低於顯著低於在磷酸鹽和瓊脂單獨滅菌的的瓊脂平板。這裡有人可能會說,我天天用瓊脂與磷酸鹽混合在一起高壓滅菌,為什麼我的大腸桿菌還是好好的活著呢?這是因為大腸桿菌非常皮實,抗自由基氧化能力非常強,正因為它這種好養的特性,它也理所應當的成為了模式生物。然而大部分環境中的微生物就沒有大腸桿菌這麼皮實了,培養基中高濃度H2O2已經足夠將他們殺死。所以當你想從環境中分離多樣性足夠高的物種時,除了要考慮使用不同配方的培養基以及培養條件,你還需要注意在高溫滅菌時不能把磷酸鹽和瓊脂放在一起,而是分別單獨滅菌後再混合。
實驗設計
為了研究這個問題日本科學家選用了首次從Gemmatimonas aurantiaca這個門中分離的一株菌T-27T進行實驗。這個門的細菌在瓊脂培養基上生長的極其緩慢或不能生長,所以多年以來一直不能在實驗室中被培養。但作者偶然發現這株菌在冷結膠( gellan gum) 培養基上長得非常好,而這個冷結膠培養基與瓊脂培養基唯一的區別就是使用的膠凝劑成分不同。因此作者懷疑瓊脂糖與培養基中其它營養組分相互作用產生的物質抑制T-27T菌株的生長。為了驗證他的假設,作者在準備瓊脂培養基時分別採用了兩種不同滅菌方法:第一種是磷酸鹽和瓊脂分別高壓蒸汽滅菌(PS法,P為磷酸鹽,S為單獨)或磷酸鹽和瓊脂一起高壓蒸汽滅菌法(PT法,T為共同蒸壓)。
然後作者在這些培養基中測量H2O2濃度,以測試活性氧(ROS)是否抑制T-27T菌株生長。此外作者還從三種不同環境來源的樣品(土壤、沉積物和水)進行了微生物的分離培養測試,以驗證不同滅菌方法對分離微生物多樣性差異造成的影響。
具體實驗方法
首先將G. aurantiaca T-27T菌在TYG液體培養基上搖瓶培養。然後設定不同濃度梯度的磷酸鹽用於培養基配製。配製培養基時分成把磷酸鹽和瓊脂混合滅菌和把瓊脂和磷酸鹽分開滅菌兩種方式。然後作者統計了該菌在不同培養基上的生長數目,以及不同培養基上的H2O2含量。
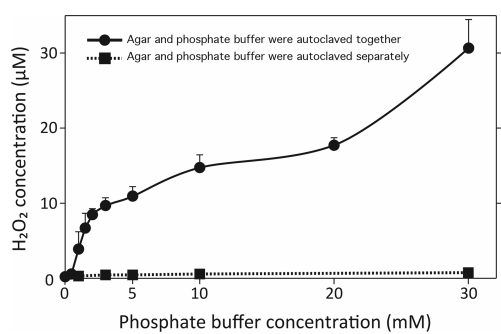
圖1展示的是瓊脂與磷酸鹽一起或分開滅菌後,H2O2的濃度變化。從圖中可以看到當瓊脂和磷酸鹽一起滅菌時,H2O2的濃度隨著磷酸鹽濃度的增加而產生的。而將瓊脂和磷酸鹽單獨滅菌的培養基中H2O2的濃度接近於零並保持不變。
從下圖1可以看出瓊脂和磷酸鹽分別進行高壓蒸汽滅菌與同時進行高壓蒸汽滅菌時,在固體培養基上形成的菌落數量有明顯差異(圖1A和B)。我們看到在不新增磷酸鹽的對照板中也能看到生長(圖1C),說明培養基中的其它營養成分含有足夠的磷酸鹽,可以供T-27T菌的生長。相反,當磷酸鹽和瓊脂一起高壓蒸汽滅菌時,在不同濃度的磷酸鹽培養基中,菌落的數量有顯著的差異。如圖A所示在0.5 mM磷酸鹽(230 CFU)濃度的培養基上菌落仍然大量存在,而在1mm磷酸鹽平板(100 CFU)上菌落數量有所減少。當磷酸鹽濃度達到1.5 mM以上(0 CFU)時則完全沒有任何菌落在培養基上生成。而最後將過氧化氫酶新增到磷酸鹽和瓊脂混合滅菌的培養基中,可以看到菌落重新在平板上大量生長,這說明磷酸鹽和瓊脂在一起高溫滅菌時產生的過氧化氫是抑制微生物生長的最主要因素。

圖2中展示的是不同滅菌方法制備培養基對T-27T菌落形成的抑制作用。
- A圖表示不同濃度磷酸鹽和瓊脂一起滅菌後T-27T生長情況
- B圖表示不同濃度磷酸鹽與瓊脂單獨滅菌再混合的T-27T生長情況
- C圖表示不新增磷酸鹽的的T-27T生長情況
- D圖表示表示最高濃度磷酸鹽和瓊脂一起滅菌後再新增過氧化氫酶後的T-27T生長情況,最高濃度磷酸鹽和瓊脂一起滅菌作為對照。
三種不同環境樣品分離培養實驗
作者準備了PT(所有組分混合滅菌), PS(組分分開滅菌後混合), and PW (培養基中不含磷酸鹽)三種培養基。然後作者用這三種培養基對來自土壤,沉積物以及河流的環境樣品進行細菌稀釋塗平板實驗。由於這些環境的差異性,在每個來源的三份樣本中形成的CFU的數量是高度可變的,特別是對於河流水樣。由於細菌分佈的不均勻性,水樣的變化很大所以造成不同重複之間細菌差異的結果較大。而在PT、PS、PW三種平板上,在PT平板上形成CFU的數量最少。從沉積物和土壤樣品中可以看到,PT平板上形成的細菌CFU的數量幾乎比PS平板上形成的細菌CFU數量低一個數量級。這表明高濃度的磷酸鹽不會抑制菌落的形成,但是當瓊脂和磷酸鹽一起高壓蒸汽滅菌時會發生反應產生H2O2從而抑制微生物菌落的形成。在大多數樣品中,PW培養基上CFU的數量與PS培養基上CFU的數量相近或高於PS培養基上CFU的數量。這些結果表明,培養基中其它營養成分中所含有的微量的磷酸已經足夠微生物在在瓊脂培養基上生長並形成菌落。並且未放在一起高溫滅菌的磷酸鹽與瓊脂不相互作用,不會抑制菌落的生長。
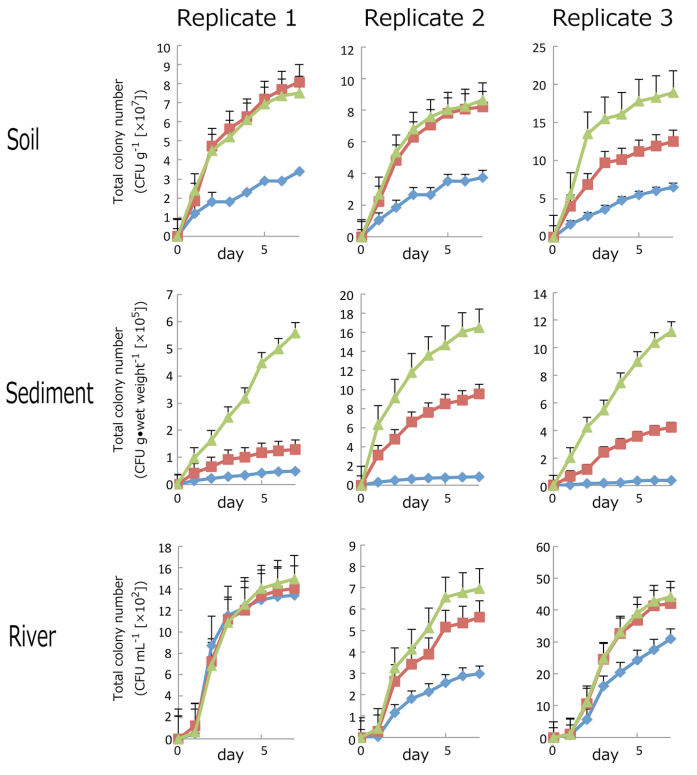
圖3表示:三種環境來源(土壤、泥沙和河水)的菌落總數;
在三個不同的介質(藍色寶石狀曲線代表瓊脂和磷酸鹽混合滅菌的 PT培養基; 紅色正方形代表瓊脂和磷酸鹽分開滅菌的PS培養基; 三角形代表不新增磷酸鹽的PW培養基)。對PT、PS、PW培養基培養7天並進行CFU計數。圖中展示的是在2到5個平板上形成30到300個菌落的平均CFU計數結果。如果菌落在整個培養基上過度生長,則培養基被排除在菌落計數之外。誤差條表示從兩個板到五個板計算的平均標準誤差。
非培養高通量測序與分離培養結果比較
通過454高通量測序的OTU註釋結果顯示,在土壤中有40個不同細菌門,在沉積物中有56個不同細菌門,在河水中有53個不同細菌門,這比分離培養得到的6個門(土壤中有6個門,沉積物中有5個門,河流中有6個門)的微生物多樣性高很多。在所有通過高通量測序獲得的60個不同的細菌門中,只有17個門的序列相對丰度高於1%。此外作者還發現當把樣品放在甘油中然後儲存在-80℃後,樣品中的稀有類群不能在培養基上分離培養了。通過β多樣性分析發現,當使用Bray-Curtis距離時,高通量測序的樣品和分離培養方法獲得的在主座標一軸上顯著被分開,在分離培養的樣品中,不同來源的樣品在分組內部的微生物構成具有一定的系統發育關係。
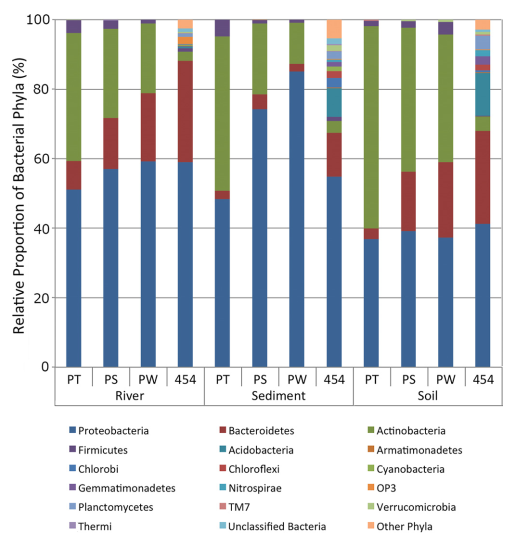
圖4表示:利用PT、PS、PW培養基和454高通量測序法,對河流、沉積物和土壤樣品中微生物相對丰度比較結果圖。所有以分離菌株以及高通量測序相對丰度大於1%的序列都包括其中。高通量測序獲得多的另外40個門被劃分到其它門中。
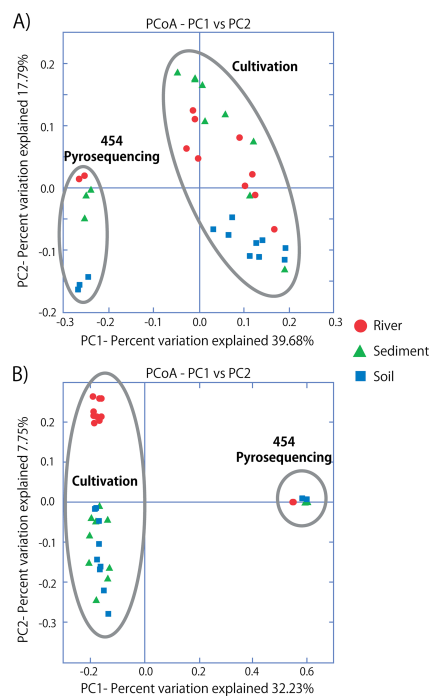
圖5表示:利用PT、PS和PW培養基從河流、沉積物和土壤樣品中分離物的Beta多樣性分析。
- A)將資料稀釋抽平到50個OTUs然後利用歐式距離(Bray-Curtis)進行多樣性計算。
- B)將資料稀釋抽平到50個OTUs然後利用非加權的UniFrac對系統發育距離進行多樣性分析。
總結
本研究中作者發現對培養基配製時,簡單的將瓊脂和磷酸鹽分開滅菌,就可以增加一種難以培養的G. aurantiaca的培養成功率,並且能顯著增加從各種環境來源分離的細菌多樣性。活性氧是已知的許多細菌生長的抑制劑,無論是從培養基中去除磷酸鹽(PW),還是將磷酸鹽和瓊脂分別高壓蒸汽(PS),得到的CFU是PT培養基的50倍。瓊脂與磷酸鹽放在一起高壓蒸汽滅菌時產生的H2O2是抑制某些類群微生物生長的一個重要因素。所以在做微生物分離培養的你,在下次配培養基時一定要記得把含磷酸鹽的物質和瓊脂分開進行滅菌。這樣,也許你一直想分到,而沒得到的菌株就能被你成功的分離培養出來啦!隨後,作者又發表了兩篇論文揭示了瓊脂中H2O2形成的機制。他證明了H2O2的生成是pH依賴性的:H2O2在高濃度鹼性或中性磷酸鹽緩衝液中生成,而在酸性緩衝液中是不生成。並且培養基溶液中的銨離子會顯著增加H2O2的生成量,從而導致培養基中更多H2O2的產生。感興趣的同學可以閱讀參考文獻中附錄文章!
References:
- Tanaka, T., Kawasaki, K., Daimon, S., Kitagawa, W., Yamamoto, K., Tamaki, H., … & Kamagata, Y. (2014). A hidden pitfall in the preparation of agar media undermines microorganism cultivability. Applied and environmental microbiology, 80(24), 7659-7666.
- Kawasaki, K., & Kamagata, Y. (2017). Phosphate-Catalyzed Hydrogen Peroxide Formation from Agar, Gellan, and κ-Carrageenan and Recovery of Microorganisms Cultivability by Catalase and Pyruvate. Applied and environmental microbiology, AEM-01366.
- Kato, S., Yamagishi, A., Daimon, S., Kawasaki, K., Tamaki, H., Kitagawa, W., … & Kamagata, Y. (2018). Isolation of Previously Uncultured Slow-Growing Bacteria by Using a Simple Modification in the Preparation of Agar Media. Appl. Environ. Microbiol., 84(19), e00807-18.
猜你喜歡
- 10000+: 菌群分析
寶寶與貓狗 提DNA發Nature 實驗分析誰對結果影響大 Cell微生物專刊 腸道指揮大腦 - 系列教程:微生物組入門 Biostar 微生物組 巨集基因組
- 專業技能:生信寶典 學術圖表 高分文章 不可或缺的人
- 一文讀懂:巨集基因組 寄生蟲益處 進化樹
- 必備技能:提問 搜尋 Endnote
- 文獻閱讀 熱心腸 SemanticScholar Geenmedical
- 擴增子分析:圖表解讀 分析流程 統計繪圖
- 16S功能預測 PICRUSt FAPROTAX Bugbase Tax4Fun
- 線上工具:16S預測培養基 生信繪圖
- 科研經驗:雲筆記 雲協作 公眾號
- 程式設計模板: Shell R Perl
- 生物科普: 腸道細菌 人體上的生命 生命大躍進 細胞暗戰 人體奧祕
寫在後面
為鼓勵讀者交流、快速解決科研困難,我們建立了“巨集基因組”專業討論群,目前己有國內外2600+ 一線科研人員加入。參與討論,獲得專業解答,歡迎分享此文至朋友圈,並掃碼加主編好友帶你入群,務必備註“姓名-單位-研究方向-職稱/年級”。技術問題尋求幫助,首先閱讀《如何優雅的提問》學習解決問題思路,仍末解決群內討論,問題不私聊,幫助同行。

學習擴增子、巨集基因組科研思路和分析實戰,關注“巨集基因組”


點選閱讀原文,跳轉最新文章目錄閱讀
https://mp.weixin.qq.com/s/5jQspEvH5_4Xmart22gjMA
