Deepgener: 預防I型糖尿病,從嬰兒時期腸道菌群出發
預防I型糖尿病,從嬰兒時期腸道菌群出發

文獻導讀
人腸道菌群會隨著年齡、飲食,用藥等因素變化而發生改變。目前,人類從出生到老年這一階段的腸道菌群的動態變化仍缺乏清晰認識。嬰兒期到兒童期這個時期被認為是人腸道菌群形成的關鍵階段。此外,這一階段的微生物和免疫之間的互作被認為是與後期多種疾病相關,特別是胰島自身免疫(IA)或I型糖尿病(T1D)。
文獻簡介
- 英文標題: The human gut micro biome in early-onset type 1 diabetes from the TEDDY study
- 中文標題:最大規模研究揭示嬰兒腸道微生物發展的三個階段及對疾病的影響
- 作者: Tommi Vatanen (First Author), Curtis Huttenhower1,2,20* & ramnik J. Xavier (Corresponding Author) [專業領域:Computational and Integrative Biology]
- 單位:Broad Institute of MIT and Harvard, Cambridge, MA, USA.
- 期刊: Nature; 影響因子: 【40.137】Doi號: 10.1038/s41586-018-0620-2
文獻摘要
目的:
I型糖尿病是因胰腺組織遭到免疫攻擊而誘發的一種糖尿病,此前研究人員推測腸道菌群和糖尿病進展之間可能存在某種未知的關係,本文希望能夠闡明機體胰腺功能或T1D和早期腸道菌群之間的潛在關聯。
設計
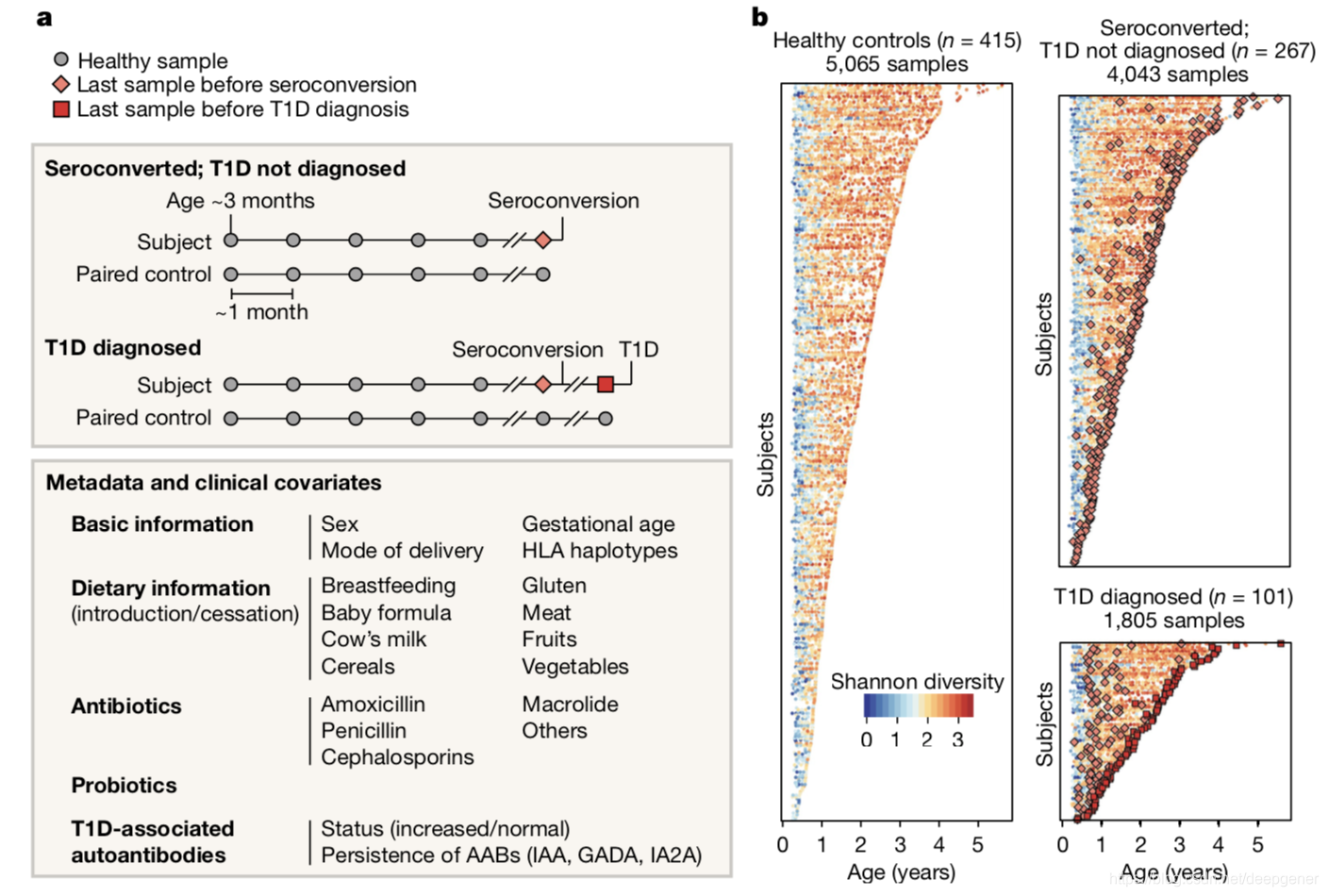
作者分析了10,913份來自於783名白人非西班牙裔兒童的腸道菌群樣本資料。從出生後三個月開始每個月收集樣本,直至The Environmental Determinants of Diabetes in the Young (TEDDY) 研究中的臨床終點。
結果:
結果表明在對照組兒童腸道菌群中包含更多與發酵和短鏈脂肪酸(SCFA)生物合成相關的基因,但這些基因與地理上不同的臨床中心的特定分類群並不一致,這表明與T1D相關的菌群在分類水平上是分散的,但在功能上更連貫。嬰兒腸道菌群的分類水平和功能水平都是動態且高度個性化的,且在生命的第一年主要由三種雙歧杆(B.bifidum,B.breve或B.longum)中的一種占主導地位或Proteobacteria門占主導地位。特別地,在母乳餵養的嬰兒中存在用於利用人乳寡糖的基因的特異性菌株B.longum。
結論
TEDDY分析提供了腸道菌群與胰島自身免疫(IA),T1D和其他早期兒童發育事件相關詳細的縱向功能譜。結合來自人群和T1D小鼠模型的現有證據,這些資料支援SCFA在早發性T1D中的保護作用。
背景介紹
在患有2型糖尿病(T2D)的成人腸道菌群中發現了產SCFA的細菌水平降低。此外,也有報道稱IA後且T1D診斷之前,患者出現腸道通透性增加和微生物多樣性降低。使用非肥胖糖尿病(NOD)小鼠模型的研究已經確定了SCFAs介導的保護作用和自身免疫中微生物組相關性別偏差的免疫機制。餵食特殊飲食的NOD小鼠增加SCFAs(醋酸鹽和丁酸鹽)的產量,使小鼠幾乎完全免受T1D的影響。嬰兒與成人的腸道菌群特徵明顯不同,微生物組成差異顯著,有氧呼吸在能量代謝中的比例更大,動態變化更為極端。這些差異在生命的最初幾年會逐漸消失,特別是固體食物的引入。個體微生物菌群發育軌跡受環境,分娩方式,母乳(配方)餵養和抗生素的影響。大多數針對腸道菌群與T1D相關的研究都是使用了16S的資料,但16S的資料不易檢測到的功能和菌株特異性差異而難以解析疾病的發病機制。
技術路線圖
結果
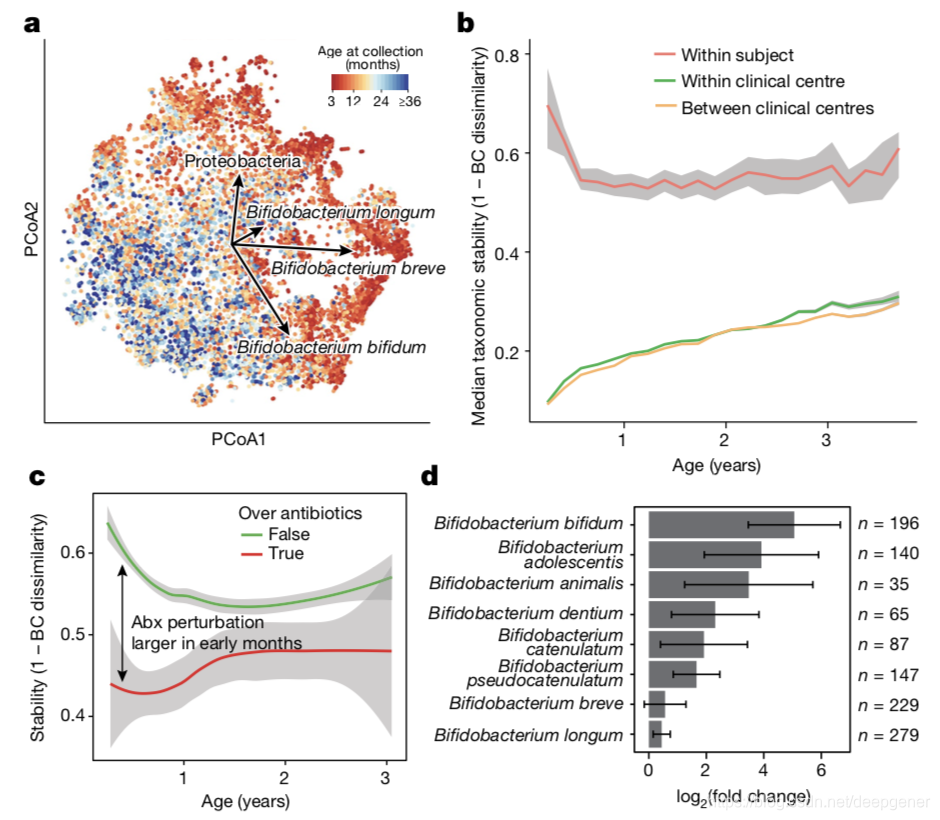
基於Bray-Curtis距離的beta多樣性結果顯示最早期樣本展示了非常強的縱向梯度和顯著的異質性,受試者之間的差異解釋了35%的腸道菌群組成變異,其次取樣時的年齡約解釋4%方差。作者發現除了受試者ID和年齡,地理位置和母乳餵養對腸道菌群的組成具有顯著影響,母乳餵養的停止對早期生活腸道菌群α多樣性具有最大的影響。口服抗生素的過程破壞了腸道菌群穩定性,且在最早期的效應最大。服用抗生素後,某些雙歧桿菌含量會下降,而B.longum和B.breve沒有系統地下降(圖2d),表明某些雙歧桿菌物種在抗生素耗盡後特別容易受到其他群落成員的競爭。鑑於它們在腸道菌群中的主導地位以及與母乳代謝相互作用的微調平衡,這一發現強調了在兒童早期接受抗生素處方的重要性,特別是在母乳餵養期間。
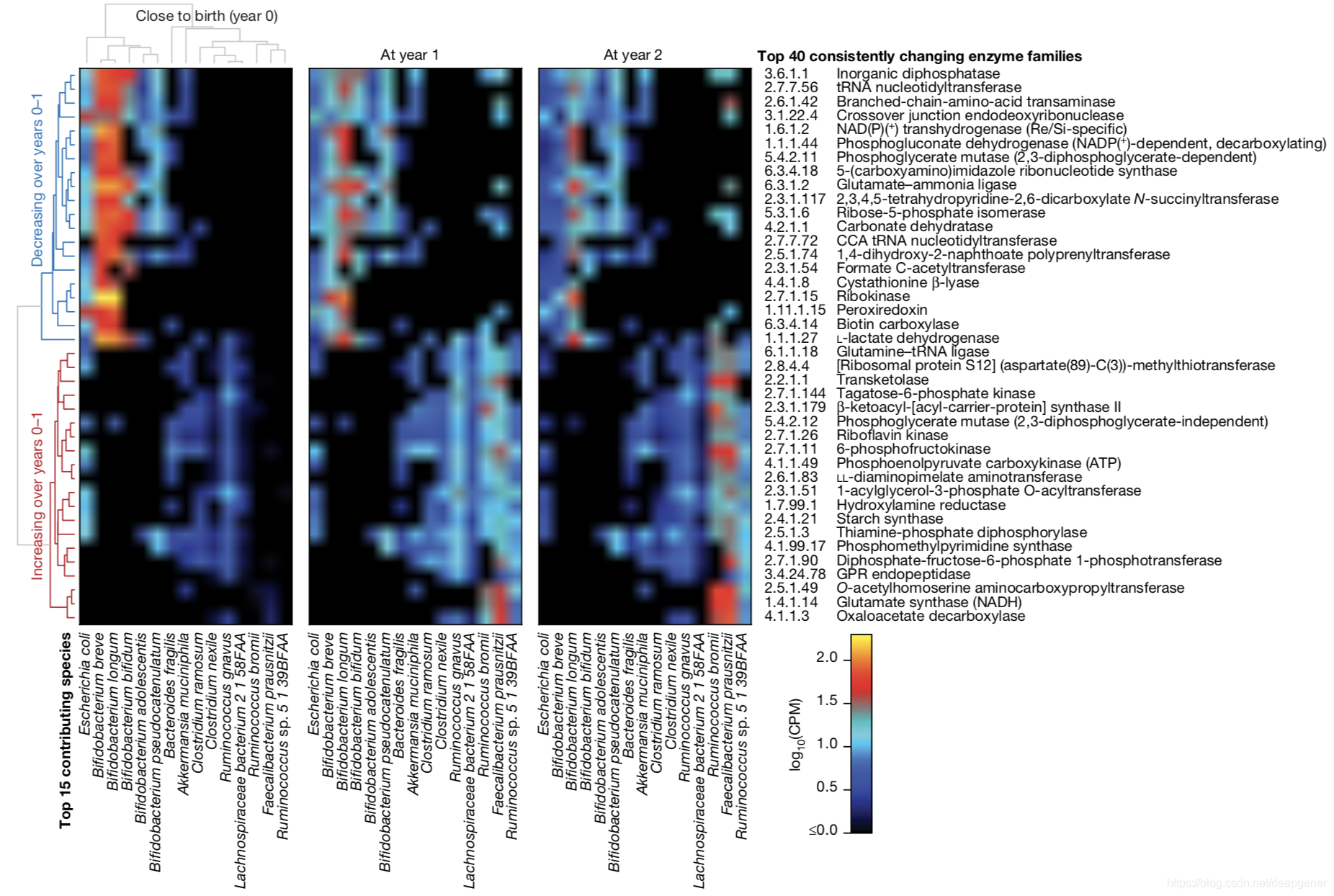
除了廣泛保守和特定的功能外,有一系列微生物代謝酶在生命的第一年中持續增加或減少,這與腸道菌結構和嬰兒飲食的變化相似。這些顯著變化突出了早期嬰兒腸道的獨特代謝環境,隨後轉變為更適合於發酵產能的成人的腸道菌群。在IA患病組和對照組群體中,對照組含有較高的Lactobacillus.rhamnosus菌,這說明可以通過早期益生菌補充來降低IA的風險。同時,對照組還具有更多的雙歧桿菌,而IA患病組具有更高的鏈球菌。在T1D病例對照比較中,對照組的嗜熱鏈球菌和乳酸乳球菌。與發酵相關的超級途徑在T1D和芬蘭IA的對照組中顯著富集,幾種促成SCFA生物合成的細菌途徑增加。具有益生菌和益生元功能的母乳是決定嬰兒腸道菌群組成的主要因素之一。在母乳餵養期間,總共觀察到41個更富集的基因家族,大多數由B.longum菌攜帶(圖4)。在含有B.longum菌的樣品中,當較少的B.longum菌菌株攜帶這些基因時這意味著斷奶後發生明顯的菌株轉變。

討論
確定個體間腸道菌群與T1D發病機制之間關係對未來靶向療法是有益的,特別是考慮本文揭示的明顯群體水平異質性。不同的內源性疾病,自身抗體(IAA與GADA)的差異,自身抗體的數量,從血清轉化到T1D診斷的時間,遺傳宿主高風險等位基因和種族背景,可能都會導致具有不同的微生物特徵。通過橫斷面資料和更詳細的縱向調查,該研究為進一步鑑定T1D風險或發病機制中具有預測性,保護性或潛在因果關係的腸道菌群奠定了基礎。
思考
儘管樣本量充足,對研究設計進行了詳細審查,並進行了全面的統計分析,在case-control比較中檢測到的大多數分類水平和功能訊號通路的效果大小和統計學意義都不大。這是由於幾個原因如T1D的endotype,時間彌散訊號,地理異質性或生命最初兩個月糞便樣本的缺乏等導致的差異。此外,這些研究中使用的資料包括來自遺傳易感性和大多數白人非西班牙裔case-control的樣本,這些樣本被設計到TEDDY研究中,不能保證結果能反映各個國家的整個TEDDY佇列或兒童人群。
前景應用
文章詳細闡述了嬰兒腸道菌群的形成,深度剖析了微生物組、嬰兒發育以及I型糖尿病之間的潛在關係,為將來靶向治療夯實基礎。
參考連結
深度基因小夥伴溫馨提示:
-
如果我們對文章理解有偏差,非常歡迎大家向我們反饋,我們會認真閱讀建議並修改,另外有意願加入我們的小團隊的老師和同學可傳送郵件至我們的郵箱:[email protected] 祝大家科研順利,生活開心!
-
想要了解更多內容請訪問我們的深度基因網站:http://deepgener.wordpress.com/
-
點選檢視上一篇文獻內容
